經典重讀丨Nat Rev Drug Discov系統生物學與代謝組學
2013年8月,英國帝國理工學院的Jeremy K. Nicholson和Ian D. Wilson在Nature Reviews Drug Discovery上發表了綜述文章“Understanding ‘Global’ Systems Biology: Metabonomics and the Continuum of Metabolism”,概述了代謝組學應用中考慮環境因素對疾病的影響,在系統生物學模型中考慮“全局”代謝網絡,來幫助理解基因-疾病關系和藥物毒性問題。

引言
系統生物學,是將基因組學、轉錄組學、蛋白質組學和代謝組學這些不同層次的數據進行整合分析,以期獲得功能性發現。從而為確定疾病病因和尋找可能的治療方法提供了新角度。“多組學”數據可以應用于新藥開發和藥物毒理分析。從建模的角度來看,單一細胞類型的微生物相關的基因-蛋白-代謝物的相互作用已經取得一定進展,即使在如此簡單的系統中,基因表達與蛋白質水平的統計學上的相關性也非常弱。而在高等動物中對“多組學”數據進行建模還存在局限性,因為相互作用的細胞類型多、數量多、空間分布不同。而且很多代謝途徑的反饋機制與基因、蛋白沒有映射,因此很多機構在完善和整合相關信息,比如KEEG。此外,人體的“系統”也很復雜,生理功能的完整性也取決于很多外部因素,甚至包括來自共生生物的基因組。考慮到哺乳動物內源性代謝物和外部因素的相互作用,無論用多么復雜的測量技術,簡單的路徑建模永遠無法描述人體疾病過程或與藥物相互作用所需要的信息豐富度。
總的來說,有兩個問題需要回答:一是如何理解疾病或藥物誘導下轉錄組學、蛋白組學和代謝組學與標準代謝途徑的關聯?特別是在哺乳動物的代謝調控功能分散在不同區域不同細胞類型時。二是如何解釋非宿主“基因組外”產生的代謝物和微生物對宿主的整體代謝、藥物吸收和毒性具有的重要影響?
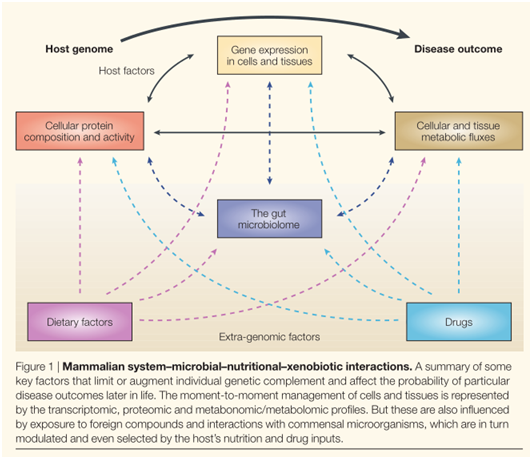
為了回答這些問題,我們重新審視了“代謝”一詞在哺乳動物中的定義,對高等動物提出了一個更完整的代謝過程。人體系統生物學最終可能更像是一個生態問題,而不是一個分子生物學問題。
一、哺乳動物代謝連續體
哺乳動物體內代謝物被分為“內源性”或“外源性”,各位有不同的代謝途徑,代表了綜合代謝和非酶轉化連續體的末端。許多所謂的內源性代謝錯誤,都會引發嚴重的罕見疾病。
二、化學和酶轉化
并非所有小分子的細胞轉化都需要酶,尤其是在藥物降解研究中。例如,通過β-內酰胺開環可以將青霉素轉化為青霉酸,這些反應可以產生毒性或過敏性活性物質。內源性代謝物的一個典型例子是丙酮,它是在長期禁食或糖尿病情況下由積累的乙酰乙酸自發脫羧形成。總的來說,這些反應的廣泛發生進一步削弱了復雜生物體中某些代謝過程的確定性。
三、宏觀和微觀代謝
藥物在體內的一相代謝(Phase I)和二相代謝(Phase II)等概念以及代謝途徑的基本思想一直都很有價值,它們提供了代謝空間的簡化圖。然而,這些反應不是有序的,而是復雜的且可相互轉化的。有研究證明,使用計算的分子參數和化學計量學建模,可以在體內預測簡單取代后的芳香化合物的主要代謝命運和尿液排泄終產物。然而,這種方法無法預測次生代謝物,因為它們的種類可能非常多,并且通常由許多條件性順序反應產生。
四、概率(Pachinko)代謝模型
所有分子與細胞成分相互作用的方式取決于其分子的理化性質及其與潛在活性部分的概率碰撞,結果由熱力學和動力學規律決定。哺乳動物的代謝轉化可被視為類似于Pachinko的模型,在“給藥”后,球(藥物分子)通過針和碰撞往下流動。每個球的目的地(代謝命運)不是絕對確定的,而是概率性的,并且受到針和出口孔分布的強烈影響。針的位置(反應酶)和球的形狀大小(理化性質)決定了穿過機器的路線(細胞或組織)以及球最終會落入機器上的哪個孔(歸宿)。在這樣一個模型中,很容易理解在受到遺傳和環境因素的罕見組合影響下產生的罕見的代謝毒性結果。
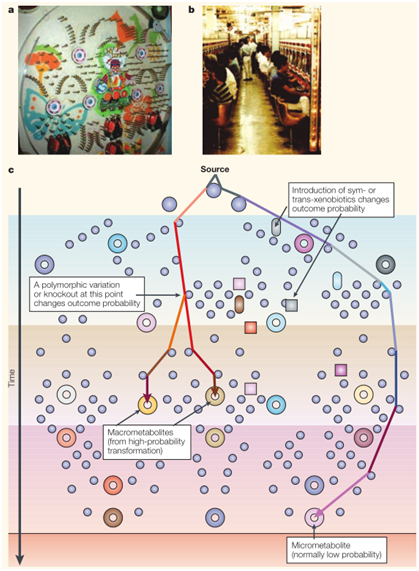
五、全局性系統生物學
“全局性””系統生物學,在藥物開發過程中,需要對整個系統進行測量和建模,包括環境因素。生物信息學工具在幫助我們處理海量數據集方面發揮著重要作用,但它本身不能回答生態-生物-化學如何相互作用的基本問題。
全局性代謝分析有兩種有用方法。第一種方法是映射策略,通過一系列多變量因子(矢量)的相互作用來描述來代謝壓力。另一種方法是采用最大熵模型(MEM),其思想為:在學習概率模型時,所有可能的模型中熵最大的模型是最好的模型;若概率模型需要滿足一些約束,則最大熵原理就是在滿足已知約束的條件(先驗知識)集合中選擇熵最大模型。不必將每個參數或組分都歸因于一條通路,而是對特定疾病或毒性過程的重要變化進行全局建模。



