經典重讀丨Nat Methods基于質譜的代謝組學
基于質譜技術的代謝組學可以同時檢測和量化數千種代謝物特征。然而,由于代謝物的化學性質復雜和動態范圍大,導致定性定量復雜。真實樣本往往是復雜體系,存在離子抑制、同分異構等問題。為了獲得高質量的代謝組學數據,德國馬普研究所的Saleh Alseekh提出了一份指南,涵蓋樣品制備、生物重復、定量分析、信號鑒定等。相關研究結果于2021年7月發表于Nature methods,文章標題為“Mass spectrometry-based metabolomics: a guide for annotation, quantification and best reporting practices”,原文鏈接為:https://doi.org/10.1038/s41592-021-01197-1。

代謝組學目前廣泛應用于植物、微生物和哺乳動物研究,是對基因組、轉錄組和蛋白質組的補充研究,是一種常用的實驗體系生物學工具。預計生命體系中存在超過100萬種代謝物,單個物種中約有1000~40000種。然而單一檢測方法所能覆蓋的代謝物數量十分有限,目前已經開發了許多不同的提取技術、分析方法的組合,來嘗試盡可能多的提高代謝物覆蓋率。同時對代謝組學數據的不同注釋,這使得代謝組數據的多樣化極高,不利于實驗室數據的相互比較。因此,需要對代謝組數據進行標準化,作者描述了基于氣相色譜/液相色譜-串聯質譜技術的代謝組學方法指南,涉及樣品制備、生物重復、定量分析、信號鑒定等,以便不同實驗室之間可對數據進行比較和分享。
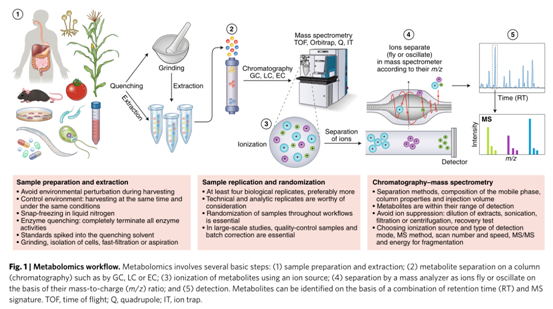
樣品采集、儲存和代謝物提取
代謝組學實驗的第一個關鍵步驟是樣本收集,理想的淬滅溶劑應能夠快速停止生物代謝過程并不影響后續代謝物的高效提取。常見的樣品類型包括細胞、組織等代謝高度活躍的系統,還有血清、血漿或尿液等生物體液樣本,每種樣本類型都需要特定的采集、淬滅和提取方法,并沒有通用型的方法。淬滅過程需要完全終止所有酶和化學活性,避免干擾當下的代謝物水平。例如,組織樣本應在快速切取后在液氮中速冷,隨后儲存于−80°C環境。
在代謝物的提取過程中,還需注意若干問題。比如當研究目標為強揮發性的代謝物時,不能對樣本進行冷凍干燥;樣品不能儲存在0至40°C下,否則物質可能會濃縮在殘留水相中;在分析前盡可能短的時間內儲存完全干燥的殘留物。此外,必須確保在解凍過程中樣本中新陳代謝保持淬滅狀態,防止某些代謝物的消耗或轉化,出現新的化合物或分解產物。培養基需要多個洗滌步驟來減少質譜檢測過程中的離子抑制影響。
樣本重復和隨機化
代謝組學研究中,為保證結果的準確性和代表性,需要設計生物重復、技術重復和分析重復。生物重復就是常說的每組個數N值。技術重復是指對同一個樣本進行多次相同的實驗操作步驟和檢測,主要是對整個實驗過程的評估,評價批次實驗之間的誤差。分析重復是指重復對完全相同的提取后樣品進行測定,主要用于評估儀器的穩定性。
生物重復最為重要,數據結果體現了樣本個體間差異和技術重復差異,當生物重復的差異遠大于技術重復時,應以生物重復為主。生物重復應至少設置四個,理想的情況是越多越好,具體的重復數量取決于實驗條件、統計需要和實驗方差。
在整個代謝組學實驗中,檢測時對生物樣品進行時空隨機化同樣重要。如果以非隨機順序分析一組樣本,治療和對照樣本或時間點可能最終在不同的條件下進行測量。因此,樣本年齡或儀器性能的變化可能會混淆解釋,掩蓋了樣本組之間的生物差異。因此,在大規模代謝組研究中,需要使用質量控制樣品來監測儀器性能和穩定性,從而保證數據質量。
定量分析
基于LC-MS和GC-MS方法進行的非靶向代謝組學,獲得的數據通常是相對定量的。這是由于復雜混合物中不同代謝物的電離效率不同,不同代謝物的色譜-質譜峰的相對強度(峰面積)與絕對濃度不直接相關。代謝物的相對濃度可以反應變化的方向(變大或變小)。然而,代謝物的絕對濃度在確定酶結合位點、代謝反應的熱力學和分子動力學研究中有更大的實用性。
當然,代謝組學實驗中使用標準曲線來確定信號強度和濃度的線性關系,來實現代謝物的絕對定量。但是由于復雜混合物中許多代謝物的關系是非線性的,這使得獲得數千種標準曲線來定量不可行。目前,常使用的定量方法是內標法定量或外標法定量。
代謝組學定量分析的另一個問題是樣本的量化單位。組織通常按鮮重或干重,體液通常按體積,細胞通常按蛋白質或細胞計數來計算。
回收率實驗
回收率實驗是指將標準化合物添加到初始提取溶劑中,以評估提取、儲存和處理過程中的損失,并可證明數據的準確性。然而,在代謝組學實驗中,由于缺乏標準品以及有些分析物是未知的原因,回收率實驗難以實現。因此,出現一種替代方法——提取重組,即將新的組織樣本的提取物通過與已知特征的參照樣本(如大腸桿菌、擬南芥或人類體液)的結合來表征。
對于已知的代謝物,建議對每種新的組織類型或物種進行回收率實驗,70~130%的回收率是可接受的范圍,回收率超出此范圍的代謝物應進行重新評估。
離子抑制
離子抑制是LC-MS分析中的一個普遍問題,因為基質效應影響共洗脫分析物的電離,影響定量的精度和準確性。評估離子抑制潛在影響的最佳方法是在重組實驗中混合兩種獨立的提取物,并評估檢測到的代謝物是否可以定量回收。
減小離子抑制的方法:(1)改進樣品制備方法,優化樣本前處理步驟,包括超聲、溶劑選擇、過濾、離心和蛋白沉淀等,其中選擇合適的吸附劑進行固相萃取(SPE)是減少基質效應的有效方法。(2)選擇合適的色譜條件,根據樣品類型和分析物性質,選擇合適的色譜柱,調節色譜條件,改變流動相的組成或梯度條件,使得感興趣的分析峰不在抑制區域洗脫。(3)選擇合適的離子源,大氣壓化學電離(APCI)比電噴霧電離(ESI)更不易受到基質效應的影響,正離子模式下化合物電離比負離子模式更容易出現離子抑制。
信號鑒定
基于質譜技術進行非靶向代謝組學實驗時,代謝物的鑒定仍是很大的挑戰。高分辨質譜可檢測到10000-100000個特征峰,除了準分子離子峰外,還經常出現加和離子峰和干擾離子峰。造成對離子峰誤判的原因包括以下幾個方面。(1)同分異構體的存在:如己糖磷酸鹽/肌醇磷酸鹽、檸檬酸鹽/異檸檬酸鹽、葡萄糖/果糖、丙氨酸/肌氨酸等,高分辨率質譜難以區分這些異構體。(2)重疊化合物的存在可能會阻礙某些代謝物的檢測:當色譜無法有效分離分析物時,分辨率不足的情況下會導致化合物信號重疊。(3)源內降解物的形成:在ESI電離中,由于水、二氧化碳或磷酸氫的損失、復雜的分子重排和其他離子的附著從而產生副產物離子。源內降解降低了代謝物母離子的信號強度,產生的碎片離子可能會干擾其它共洗脫化合物的分析。
此外,非靶代謝組學分析的一個關鍵方面是峰值過濾。此類研究中的代謝組學數據集包含大量無效信息,這些特征可能會阻礙后續的統計分析,可通過減少信號和噪聲的數量以及注釋常見同位素和加合物來改善和清潔數據。已有多種軟件工具可根據給定數據集的特定特征進行數據過濾。

報告注釋
為了在不同實驗室之間進行數據比較,方便其他實驗人員進行重現實驗,需要對樣品制備和分析程序進行詳細描述,包括前處理方法、色譜和質譜參數。
(1)色譜:流動相組成、色譜柱品牌和型號、柱溫、流速和進樣量;
(2)質譜:離子源和檢測模式類型、MS方法、掃描次數和速度以及MS/MS參數,包括分辨率設置和用于碎裂的能量。
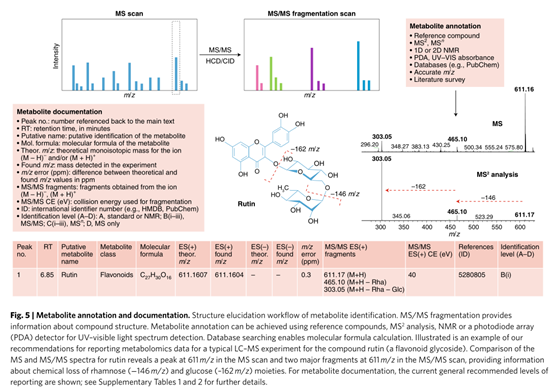
作者提供簡化、更簡單的報告注釋示例(下圖),以確保廣泛的適用性和相關性。
總結
本研究提出了提高代謝數據集質量和建議,以滿足跨實驗室可比的需要。這些建議包括樣品制備、生物重復、定量分析、信號鑒定、報告注釋等形成指南。指南將使讀者能夠評估所報告數據的質量,使研究人員能有一個簡單的途徑來獲得所需的信息并注釋自己的實驗結果,此外還可以使多個實驗室的數據更容易相互比較。這些都有助于代謝組學的發展。



