關(guān)于我們
重磅綜述丨Trends Pharmacol Sci腸道菌群代謝產(chǎn)物
人體腸道菌群豐富多樣,與宿主的生理、免疫和多種疾病相關(guān)。題為“Deciphering the Chemical Lexicon of Host–Gut Microbiota Interactions ”的研究論文,綜述了近年來(lái)的研究結(jié)果,關(guān)注腸道菌群代謝物及其調(diào)節(jié)宿主健康和疾病中的作用,這些代謝物介導(dǎo)腸道微生物群和宿主的相互作用,可能為相關(guān)疾病的診斷和治療提供指導(dǎo)作用。原文鏈接:https://doi.org/10.1016/j.tips.2019.04.006

腸道微生物代謝產(chǎn)物介導(dǎo)宿主-菌群相互作用
腸道微生物的組成與宿主健康狀況相關(guān),它們參與調(diào)節(jié)宿主生理的許多方面,大量證據(jù)表明,腸道微生物群對(duì)我們腸道免疫系統(tǒng)的正常發(fā)育和調(diào)節(jié)至關(guān)重要。微生物代謝產(chǎn)物可以激活或抑制內(nèi)源性信號(hào)通路,也可為宿主細(xì)胞提供營(yíng)養(yǎng)來(lái)源,調(diào)節(jié)腸道微環(huán)境,宿主-微生物的相互作用與人類健康和多種疾病有關(guān)。
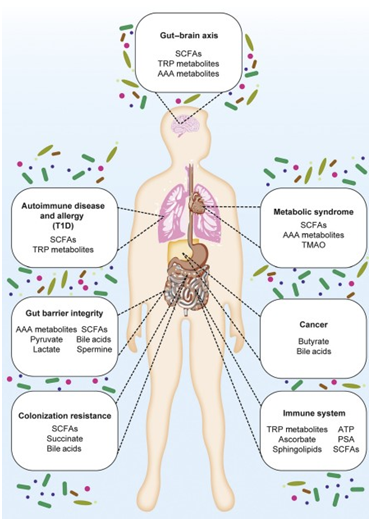
短鏈脂肪酸(SCFAs)對(duì)寄主健康的影響
短鏈脂肪酸由膳食纖維經(jīng)過細(xì)菌發(fā)酵產(chǎn)生,包括乙酸、丙酸、丁酸和戊酸等,是腸腔內(nèi)最豐富的微生物代謝物之一。短鏈脂肪酸通過以下幾種機(jī)制促進(jìn)宿主與微生物的交流:
-
作為內(nèi)源性代謝物生成的碳來(lái)源;
-
作為激活宿主G-蛋白偶聯(lián)受體(GPCRs)的信號(hào)分子;
-
抑制組蛋白去乙酰化酶(HDACs),影響宿主基因的表達(dá)。
共生微生物的耐受性依賴于促炎和抗炎信號(hào)的微妙平衡,由不同類型的免疫細(xì)胞調(diào)節(jié)。短鏈脂肪酸,包括戊酸酯,可通過提高葡萄糖氧化,增加調(diào)節(jié)性B細(xì)胞,促進(jìn)微生物耐受性。戊酸酯還可通過抑制HDACs,達(dá)到抑制Th17細(xì)胞反應(yīng)的目的。另外,研究發(fā)現(xiàn)短鏈脂肪酸可通過上調(diào)B細(xì)胞代謝來(lái)介導(dǎo)促炎作用,從而增加體內(nèi)IgG和IgA的產(chǎn)生,從而調(diào)節(jié)穩(wěn)態(tài)和病原體特異性免疫反應(yīng)。上述結(jié)果表明,短鏈脂肪酸可以促進(jìn)腸道內(nèi)的抗炎環(huán)境,同時(shí)增強(qiáng)宿主對(duì)病原體和病原體的防御。
-
短鏈脂肪酸改善自身免疫性疾病和過敏
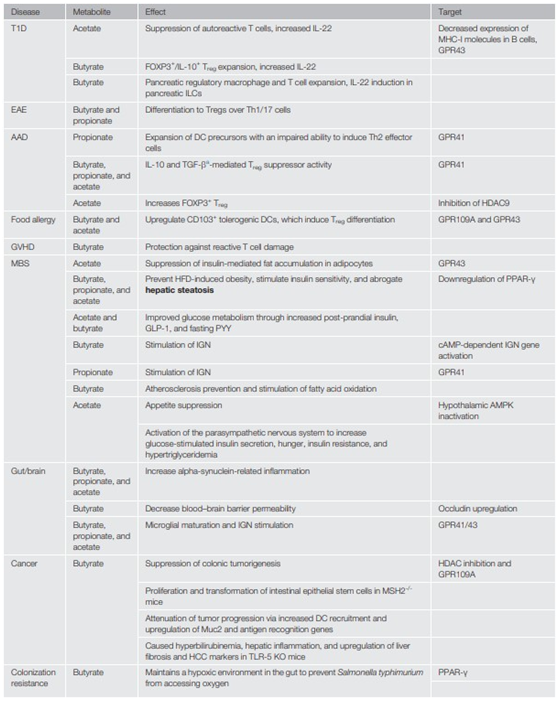
短鏈脂肪酸通過增加Foxp3+CD4+ Treg細(xì)胞分化來(lái)促進(jìn)抗炎的能力,可以改善自身免疫性疾病,如免疫穩(wěn)態(tài)被破壞導(dǎo)致的1型糖尿病(T1D)。非肥胖性糖尿病(NOD)小鼠T1D模型,被喂養(yǎng)的乙酰化淀粉發(fā)酵成乙酸和丁酸后出現(xiàn)膨化現(xiàn)象,乙酸鹽激活GPR43抗體,丁酸鹽誘導(dǎo)Foxp3+CD4+ Treg細(xì)胞,降低腸道擬桿菌數(shù)量和疾病嚴(yán)重程度。乙酸鹽和丁酸鹽還通過激活腸上皮細(xì)胞(IECs)和CD103+中的GPR43和GPR109a抑制對(duì)口服抗原的免疫應(yīng)答,以抵抗食物過敏。
-
短鏈脂肪酸調(diào)節(jié)腸道屏障功能
腸道免疫系統(tǒng)接觸結(jié)腸內(nèi)容物會(huì)導(dǎo)致炎癥,因此腸道上皮屏障的維持對(duì)免疫穩(wěn)態(tài)至關(guān)重要。短鏈脂肪酸通過抑制組蛋白乙酰化酶和激活G蛋白偶聯(lián)受體來(lái)增強(qiáng)腸道上皮屏障的完整性,從而增加宿主防御。短鏈脂肪酸還通過G蛋白偶聯(lián)受體GPR43和GPR109A介導(dǎo)的NOD樣受體熱蛋白結(jié)構(gòu)域相關(guān)蛋白3(NLRP3)激活來(lái)增強(qiáng)腸道屏障功能,可以改善小鼠的結(jié)腸炎。乙酸鹽、丙酸鹽和丁酸鹽可以激活GPR41/43,而目前已知只有丁酸鹽可以激活GPR109A。低氧誘導(dǎo)因子(HIF)是一種維持組織屏障功能的重要轉(zhuǎn)錄因子,丁酸鹽通過穩(wěn)定HIF來(lái)增加腸道屏障的完整性。
-
短鏈脂肪酸可加重或減輕代謝綜合征(MBS)
代謝綜合征在許多國(guó)家的發(fā)病率日益嚴(yán)重,其特征有肥胖、高密度脂蛋白(HDL)膽固醇降低、血壓和甘油三酯升高、心臟病和2型糖尿病(T2D)等。在高脂飲食(HFD)喂養(yǎng)的小鼠中,短鏈脂肪酸可介導(dǎo)白色脂肪組織中的GPR43,以降低胰島素敏感性和脂肪堆積,GPR43通過刺激抗炎M2巨噬細(xì)胞中腫瘤壞死因子α(TNF-α)的表達(dá)來(lái)促進(jìn)脂肪組織中的炎癥信號(hào),可能是由于TNF-α通過調(diào)節(jié)脂肪組織中的胰島素信號(hào)抑制脂肪堆積。短鏈脂肪酸通過下調(diào)脂肪過氧化物酶體增殖物激活受體γ(PPAR-γ)可減輕HFD誘導(dǎo)的肥胖和胰島素抵抗,肝臟PPAR-γ下調(diào)可防止肝臟中異常的脂肪堆積。
短鏈脂肪酸還可通過調(diào)節(jié)食欲來(lái)改變行為。研究表明,對(duì)HFD喂養(yǎng)的小鼠急性給予醋酸鹽可減少食物攝入量并誘導(dǎo)下丘腦出現(xiàn)厭食表型。另外,醋酸鹽的增加可通過副交感神經(jīng)系統(tǒng),上調(diào)葡萄糖刺激的胰島素分泌、饑餓、胰島素抵抗和高甘油三酯血癥,共同驅(qū)動(dòng)MBS。
-
短鏈脂肪酸調(diào)節(jié)腸-腦軸
除了調(diào)節(jié)進(jìn)食行為,短鏈脂肪酸還介導(dǎo)大腦和腸道之間的相互交流。短鏈脂肪酸被認(rèn)為可增加帕金森病病人的α-突觸核蛋白相關(guān)炎癥,將帕金森人類受試者的腸道菌群轉(zhuǎn)移復(fù)制到健康小鼠的腸道,可導(dǎo)致健康小鼠運(yùn)動(dòng)損傷。短鏈脂肪酸還能通過上調(diào)緊密連接蛋白Occludin降低血腦屏障的通透性。因此,短鏈脂肪酸促進(jìn)屏障完整性的作用并不局限于腸上皮屏障。短鏈脂肪酸能逆轉(zhuǎn)無(wú)菌小鼠中的整體小膠質(zhì)細(xì)胞成熟缺陷,表明短鏈脂肪酸能在穩(wěn)態(tài)條件下調(diào)節(jié)中樞神經(jīng)系統(tǒng)(CNS)中的免疫細(xì)胞。
腸道微生物色氨酸(TRP)代謝調(diào)節(jié)宿主免疫力
腸道微生物對(duì)色氨酸分解代謝產(chǎn)生含吲哚代謝物,通過激活芳香烴受體(AHR)來(lái)調(diào)節(jié)宿主的免疫系統(tǒng),AHR是一種調(diào)節(jié)免疫的配體門控轉(zhuǎn)錄因子。色氨酸代謝物通過刺激AHR上調(diào)抗炎反應(yīng),維持宿主-腸道菌群的內(nèi)穩(wěn)態(tài)。
-
色氨酸代謝物減輕炎癥和自身免疫性疾病
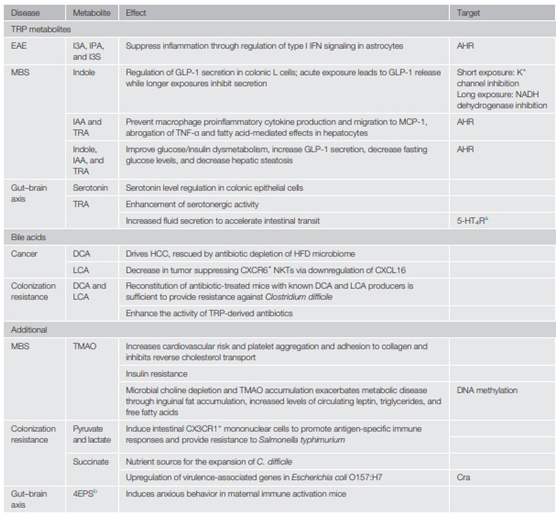
羅伊氏乳桿通過AHR作用產(chǎn)生吲哚-3乳酸,可將CD4+上皮內(nèi)淋巴細(xì)胞(IELs)分化為CD4/CD8雙陽(yáng)性IELs,這是一種預(yù)防腸道炎癥的調(diào)節(jié)細(xì)胞。研究發(fā)現(xiàn),吲哚-3-乙酸(IAA)和色胺(TRA)可減少巨噬細(xì)胞中促炎介質(zhì)的產(chǎn)生。
-
色氨酸代謝物增強(qiáng)腸道屏障功能
Card9是炎癥性腸病的一個(gè)風(fēng)險(xiǎn)等位基因,缺乏該基因的小鼠對(duì)葡聚糖硫酸鈉(DSS)結(jié)腸炎和色氨酸代謝受損的腸道菌群的易感性增加。將Card9-/-菌群移植轉(zhuǎn)移到無(wú)菌小鼠,隨后通過吲哚代謝物產(chǎn)生乳酸菌定植或AHR激動(dòng)劑作為治療。吲哚能夠通過增加介導(dǎo)腸上皮通透性的根尖連接蛋白的表達(dá)來(lái)增加腸屏障功能,從而改善與DSS結(jié)腸炎相關(guān)的病理。
-
色氨酸代謝物預(yù)防代謝綜合征
腸道微生物色氨酸代謝物預(yù)防代謝綜合征,主要是因?yàn)锳HR參與了對(duì)厭食激素分泌以及對(duì)葡萄糖和胰島素調(diào)節(jié)代謝的調(diào)節(jié),吲哚調(diào)節(jié)厭食激素GLP-1的釋放,是治療MBS的一個(gè)潛在靶點(diǎn)。AHR激活可降低空腹血糖水平,改善葡萄糖和胰島素代謝異常,并增加GLP-1的分泌。與SCFAs類似,色氨酸代謝物(如IAA)可減少細(xì)胞因子誘導(dǎo)的肝細(xì)胞脂肪生成。
色氨酸被腸道菌群代謝生成影響宿主血清素活性的神經(jīng)遞質(zhì),血清素也是腸道菌群代謝色氨酸的產(chǎn)物,對(duì)宿主生物合成和這種神經(jīng)遞質(zhì)的水平有重要影響。此外,腸內(nèi)梭狀芽孢桿菌通過色氨酸分解代謝產(chǎn)生神經(jīng)遞質(zhì)色胺(TRA)。色氨酸還被證明可以激活GPCR 5 -羥色胺受體-4,進(jìn)而驅(qū)動(dòng)腸道液體分泌,加速腸道運(yùn)輸。
次級(jí)膽汁酸對(duì)宿主反應(yīng)的調(diào)控
初級(jí)膽汁酸由宿主在肝臟中產(chǎn)生,促進(jìn)膳食脂質(zhì)和脂溶性維生素的吸收,初級(jí)膽汁酸大部分被肝臟重新吸收,小部分進(jìn)入大腸,被微生物群進(jìn)一步代謝成次級(jí)膽汁酸,對(duì)宿主具有重要的生理作用。
腸道菌群通過激活炎癥小體增加白介素-18水平影響腸道屏障完整性。腸道菌群解除牛磺酸偶聯(lián)初級(jí)膽汁酸的連接,增加宿主的牛磺酸池,導(dǎo)致NLRP6炎癥小體的激活,增加白介素-18的分泌和炎癥反應(yīng)。此外,次級(jí)膽汁酸脫氧膽酸(Deoxycholic acid,DCA)通過法尼索樣X受體介導(dǎo)下調(diào)前列腺素E2水平,調(diào)節(jié)腸隱窩再生和修復(fù),促進(jìn)屏障功能的完整。
-
癌癥與定植抵抗
研究發(fā)現(xiàn),HFD誘導(dǎo)的肥胖導(dǎo)致DCA水平的增加,進(jìn)而刺激肝細(xì)胞癌的活性。梭狀芽孢桿菌產(chǎn)生的次級(jí)膽汁酸也通過負(fù)調(diào)控CXCL16促進(jìn)肝臟腫瘤的發(fā)生,引起抑瘤CXCR6+自然殺傷T細(xì)胞(NKTs)的減少。不良微生物群中次級(jí)膽汁酸譜的改變也可能通過與短鏈脂肪酸的協(xié)同作用導(dǎo)致肝癌。次級(jí)膽汁酸被認(rèn)為是導(dǎo)致肝癌的原因,同時(shí)也能維持腸道屏障,防止腸道病原體的定植。致癌的次級(jí)膽汁酸在定植抵抗中發(fā)揮著有益作用,DCA和石膽酸(LCA)抑制艱難梭菌的生長(zhǎng)。次級(jí)膽汁酸對(duì)宿主的有益和有害影響,取決于細(xì)菌代謝物如何在整體水平上調(diào)節(jié)和作用。因此,需要進(jìn)一步研究各種模型以及這些代謝物對(duì)附加代謝物的影響。
其他調(diào)節(jié)宿主健康和免疫的微生物代謝物反應(yīng)
腸道微生物代謝膽堿、磷脂酰膽堿和L-肉堿產(chǎn)生三甲胺,三甲胺被宿主肝臟氧化為三甲胺n -氧化物(TMAO)。TMAO水平依賴于L-肉堿和膽堿代謝,與心血管疾病的風(fēng)險(xiǎn)增加相關(guān)。TMAO可增加血小板聚集和對(duì)膠原蛋白的粘附,并可加重體內(nèi)血栓形成。腸道微生物L(fēng)-肉堿代謝影響心血管健康,還與胰島素抵抗有關(guān)。細(xì)菌分解代謝膽堿導(dǎo)致TMAO的生成和膽堿的缺乏,進(jìn)一步通過調(diào)節(jié)DNA甲基化加重代謝紊亂。
丙酮酸由膳食纖維經(jīng)微生物發(fā)酵產(chǎn)生。細(xì)菌丙酮酸和乳酸誘導(dǎo)小腸CX3CR1+單核細(xì)胞向腸腔內(nèi)延伸樹突,捕獲腸腔抗原,促進(jìn)抗原特異性免疫反應(yīng),從而對(duì)沙門氏菌感染產(chǎn)生抗性。
-
乳酸
微生物產(chǎn)生的乳酸有利于維持腸道屏障,通過GPR81依賴的機(jī)制促進(jìn)腸干細(xì)胞的分化。
-
精胺和組胺
這些代謝物由宿主和腸道菌群共同產(chǎn)生,通過抑制NLRP6炎癥小體降低IL-18水平,從而降低腸道上皮屏障完整性。
結(jié)論和展望
了解腸道菌群如何調(diào)節(jié)宿主生理的分子機(jī)制對(duì)于理解這些微生物在我們體內(nèi)的作用至關(guān)重要。腸道菌群產(chǎn)生的代謝物作為化學(xué)信使,介導(dǎo)微生物與宿主之間的相互作用,對(duì)人體健康具有雙相作用。這些代謝物與許多疾病相關(guān),包括MBS、IBD、癌癥、自身免疫性疾病、過敏和神經(jīng)退行性疾病,腸道菌群代謝產(chǎn)物也被證明可增強(qiáng)腸道病原體的定植抗性。
全面了解所有腸道微生物產(chǎn)生的小分子代謝物、分子靶標(biāo)及其生物學(xué)意義仍然是該領(lǐng)域的一個(gè)重要目標(biāo)。開發(fā)新的方法來(lái)破譯宿主-腸道菌群在系統(tǒng)水平上的串?dāng)_是領(lǐng)域的前沿。與傳統(tǒng)的代謝組學(xué)方法不同,宏基因組數(shù)據(jù)可以通過生物信息學(xué)方法挖掘出某些生物合成代謝物的操縱子。此外,分析現(xiàn)有宏基因組數(shù)據(jù)的新計(jì)算方法,使鑒定代謝物水平和疾病結(jié)果之間的關(guān)聯(lián)成為可能。系統(tǒng)級(jí)的方法和新方法將對(duì)微生物代謝物介導(dǎo)的宿主-腸道菌群相互作用提供更深入的理解。未來(lái)的研究將包括發(fā)現(xiàn)新的微生物代謝物,鑒定代謝物產(chǎn)生的細(xì)菌種類,了解這些代謝物對(duì)宿主健康和疾病的個(gè)體和系統(tǒng)影響。



